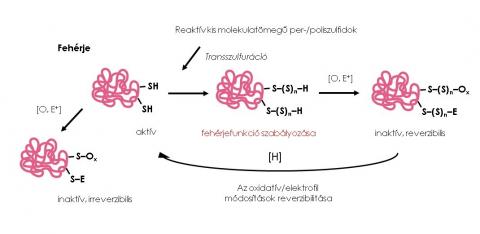
A fehérje-fehérje kölcsönhatások útján képződő poszttranszlációs módosítások központi szereppel bírnak a daganatsejtek jelátviteli folyamataiban, amelyek a célzott terápiás eljárások célpontjai. A tumorsejtekre megváltozott anyagcsere és mitokondriális működés jellemző, melynek következménye a reaktív oxigénszármazékok magasabb szintje, ezáltal pedig az oxidatív hatások módosulása. A reaktív kén származékok funkcionális és szabályozó szerepe napjainkra már elismert, az előbbi folyamatokban pedig kiemelt szerepet játszanak. A Nemzeti Tumorbiológiai Laboratórium II. alprogramjának keretében új, a redox rendszerek modulálásán alapuló, innovatív terápiák fejlesztésén dolgozunk, többek között az átprogramozott ciszteinmetabolizmus terápiás kiaknázása által.
Kutatómunkám során két kis jelátviteli molekula, a szulfid és a nitrogén-monoxid által vezérelt jelátviteli utak összefonódását tanulmányozom. A két kismolekula kölcsönösen hat az egymás bioszintéziséért felelős enzimekre, valamint ők maguk és metabolitjaik kölcsönhatása révén összefonódhatnak az általuk vezérelt jelátviteli folyamatok. Kísérleteim fókuszában a nitrozoperszulfid áll, amely a szulfid és a nitrogén-monoxid kölcsönhatás egyik fő köztiterméke. Korábbi eredményeim arra engednek következtetni, hogy a nitrozoperszulfid ellenáll a sejten belüli reduktív rendszereknek, ezáltal pedig szulfán-kén transzferként és donorként funkcionál, a tiolok per- és poliszulfidációja által fehérje poszttranszlációs módosulatok kialakulásához vezetve. Másik bomlásterméke, a nitrogén-monoxid is befolyásolhatja a fehérjék redox állapotát, ezáltal pedig aktivitásukat és funkciójukat. Kutatásom során a nitrozoperszulfid (és bomlástermékei) által előidézett fehérje poszttranszlációs folyamatok mechanizmusait tanulmányozom.
Cisztein származékok poliszulfidációjának biológiailag releváns mechanizmusai
2022. augusztus 1. hétfő, 19:50
Képek
- A hozzászóláshoz be kell jelentkezni