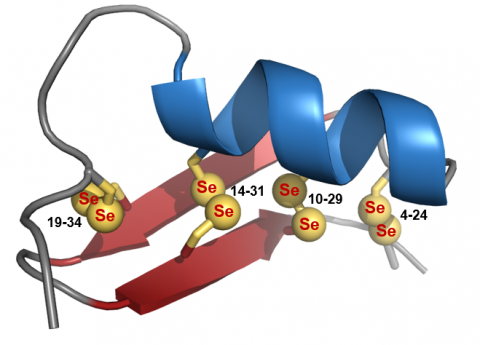
A Kv1.3 feszültségfüggő káliumcsatorna szelektív inhibitorai ígéretes gyógyszerjelöltnek tűnnek bizonyos autoimmun betegségek kezelésében. A 35 aminosavból felépülő, 4 diszulfid-kötést tartalmazó Anuroctoxin (AnTx) nevű skorpiótoxin hatékonyan blokkolja a Kv1.3 feszültségfüggő káliumcsatornát, azonban hasonló módon hat a Kv1.2 csatornára is. A toxin potenciális gyógyászati alkalmazásának javítása érdekében együttműködő partnereink megterveztek, illetve szilárdfázisú peptidszintézissel előállítottak egy olyan származékot ([N17A/F32T]-AnTx), amely megőrizte a Kv1.3 csatornához való affinitást, ugyanakkor a kiindulási peptidhez képest 2500-szoros szelektivitásbeli javulást mutat a két káliumcsatorna tekintetében.[1] A szerkezetileg rendkívül fontos diszulfid-hidak egyértelmű azonosítása végett a [N17A/F32T]-AnTx szeléntartalmú analógja – melyben minden ciszteint szelenociszteinre cseréltek – szintén előállításra került.[2] Ezáltal lehetőségünk nyílt a 77Se mag kedvező NMR tulajdonságainak kiaknázására a peptid szerkezetvizsgálatában. A biológiailag aktív peptidtoxinok szerkezetét és konformációs mozgását modern NMR (beleértve általunk kifejlesztett, 1H-77Se korrelációs kísérleteket) és molekuladinamikai módszerekkel jellemeztük.[1,2] Előadásomban rámutatok fontos molekuláris szerkezet, dinamika és biológiai hatás közötti összefüggésekre.
[1] A. Bartok, K. Fehér, A. Bodor, K. Rákosi, G. K. Tóth, K. E. Kövér, G. Panyi, Z. Varga, Sci. Rep. 2015, 5, 18397.
[2] K. Fehér, I. Timári, K. Rákosi, J. Szolomájer, T. Z. Illyés, A. Bartok, Z. Varga, G. Panyi, G. K. Tóth, K. E. Kövér, Chem. Sci. 2016, 7, 2666.